Кровяная кардиоплегия
Мартин Юрген и Кристоф Бенк
Клиника унивеситета Фрайбурга,
Отделение сердечно - сосудистой хирургии.
MMCTS (October 9, 2006). doi:10.1510/mmcts.2004.000745
Перевод Пономаренко И.В., НИИ Кардиологии, Томск
ВВЕДЕНИЕ
![]() В настоящее время кровяная кардиоплегия является наиболее распространенным
методом защиты миокарда в американских и в большинстве западноевропейских
клиник. Технические аспекты применения данной методики, являющейся результатом
многочисленных экспериментальных исследований и клинического применения,
включают в себя такие опции, как повторная кардиоплегия холодной кровью,
кардиоплегическая реперфузия теплой кровью, тепловая индукция, анте-
и ретроградная подача кардиоплегии, непрерывная коронарная перфузия холодной
кровью и прерывистая "тепловая" кровяная кардиоплегия.
В настоящее время кровяная кардиоплегия является наиболее распространенным
методом защиты миокарда в американских и в большинстве западноевропейских
клиник. Технические аспекты применения данной методики, являющейся результатом
многочисленных экспериментальных исследований и клинического применения,
включают в себя такие опции, как повторная кардиоплегия холодной кровью,
кардиоплегическая реперфузия теплой кровью, тепловая индукция, анте-
и ретроградная подача кардиоплегии, непрерывная коронарная перфузия холодной
кровью и прерывистая "тепловая" кровяная кардиоплегия.
![]() Предпочтительность кровяной кардиоплегии перед прочими методами защиты
миокарда объясняется идеальным сочетанием онкотических, буферных, реологических
и антиоксидантных свойств крови как кардиоплегического носителя, обеспечивающих
наилучшее удовлетворение потребности миокарда в кислороде и, как следствие,
предотвращение ишемического и уменьшение реперфузионного повреждений.
Предпочтительность кровяной кардиоплегии перед прочими методами защиты
миокарда объясняется идеальным сочетанием онкотических, буферных, реологических
и антиоксидантных свойств крови как кардиоплегического носителя, обеспечивающих
наилучшее удовлетворение потребности миокарда в кислороде и, как следствие,
предотвращение ишемического и уменьшение реперфузионного повреждений.
![]() Защитный потенциал кровяной кардиоплегии реализуется за счет синергического
эффекта следующих ее компонентов:
Защитный потенциал кровяной кардиоплегии реализуется за счет синергического
эффекта следующих ее компонентов:
- Гиперкалиемия: индукция и поддержание кардиоплегической остановки сердца;
- Гипокальцемия: предупреждение избыточного накопления кальция в митохондриях кардиомиоцитов и их необратимого повреждения;
- Трис-буфер: предупреждение тканевого ацидоза;
- Гиперосмолярность и гипергликемия: предотвращение отека миокарда;
- Глутамат и аспартат: восполняют истощение в период ишемии ключевых метаболитов цикла Кребса, поддерживая аэробный метаболизм и репаративные процессы в миокарде.
![]() Ниже описана так называемая "стандартная кровяная кардиоплегия" - метод,
разработанный исследовательской группой G.Buckberg, эффективность которого
была показана в ведущих кардиохирургических центрах мира.
Ниже описана так называемая "стандартная кровяная кардиоплегия" - метод,
разработанный исследовательской группой G.Buckberg, эффективность которого
была показана в ведущих кардиохирургических центрах мира.
![]() Кардиопротекция в данном случае обеспечивается подачей в коронарное
русло смеси собственной крови пациента и коммерческого кристаллоидного
раствора (Kohler-Chemie, Alsbach-Hahnlein,
Germany) в соотношении 4:1.
Кардиопротекция в данном случае обеспечивается подачей в коронарное
русло смеси собственной крови пациента и коммерческого кристаллоидного
раствора (Kohler-Chemie, Alsbach-Hahnlein,
Germany) в соотношении 4:1.
ХИРУРГИЧЕСКАЯ ТЕХНИКА
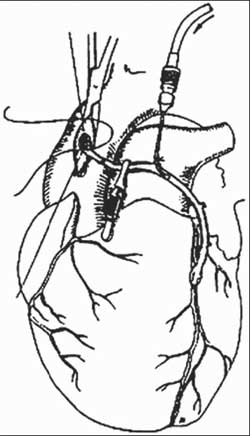
![]() Артериальная и венозная канюляция выполняются в соответствии с планом
оперативного вмешательства. После подключения АИКа для проведения комбинированной
кардиоплегии устанавливают антеградную кардиоплегическую канюлю с дренажной
линией в восходящую аорту [1] и ретрогадную кардиоплегическую канюлю
в коронарный синус [2], после чего соединяют канюли с линией подачи кардиоплегического
раствора и измерения давления.
Артериальная и венозная канюляция выполняются в соответствии с планом
оперативного вмешательства. После подключения АИКа для проведения комбинированной
кардиоплегии устанавливают антеградную кардиоплегическую канюлю с дренажной
линией в восходящую аорту [1] и ретрогадную кардиоплегическую канюлю
в коронарный синус [2], после чего соединяют канюли с линией подачи кардиоплегического
раствора и измерения давления.
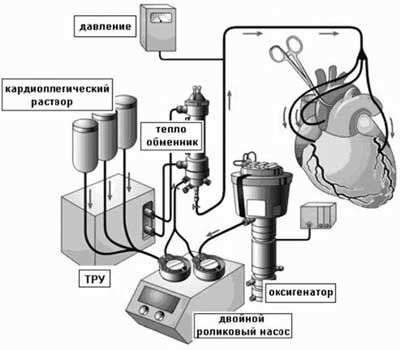
![]() После начала ИК и наложения зажима на аорту перфузиолог начинает проводить
кардиоплегию путем подачи оксигенированной крови, смешанной с кристаллоидным
раствором, с помощью двойного роликового насоса (рис.1). При этом кровяной
кардиоплегический раствор проходит через специальный теплообменник. Для
предотвращения газовой эмболии коронарных артерий необходимо тщательно
удалить воздух из системы и корня аорты.
После начала ИК и наложения зажима на аорту перфузиолог начинает проводить
кардиоплегию путем подачи оксигенированной крови, смешанной с кристаллоидным
раствором, с помощью двойного роликового насоса (рис.1). При этом кровяной
кардиоплегический раствор проходит через специальный теплообменник. Для
предотвращения газовой эмболии коронарных артерий необходимо тщательно
удалить воздух из системы и корня аорты.
![]() В рутинной сердечной хирургии используют перфузионный индекс 2,6 л/мин
на м2, перфузионное давление 60- 80 мм рт.ст., при температуре 35oС.
В рутинной сердечной хирургии используют перфузионный индекс 2,6 л/мин
на м2, перфузионное давление 60- 80 мм рт.ст., при температуре 35oС.
 |
|
ПРИМЕНЕНИЕ СТАНДАРТНОЙ КРОВЯНОЙ КАРДИОПЛЕГИИ
![]() Защита миокарда при кардиохирургическом вмешательстве может быть условно
разделена на несколько фаз:
Защита миокарда при кардиохирургическом вмешательстве может быть условно
разделена на несколько фаз:
- Холодовая индукция. Снижение объемной скорости перфузии и наложение зажима на аорту. Подача холодного (8-12oС) кардиоплегического раствора антеградно и ретроградно (по 2 минуты) до полной остановки сердца со скоростью 200 мл/мин (при выраженной гипертрофии скорость увеличивают до 300 мл/мин).
- Повторные инфузии кардиоплегии. Во время пережатия аорты холодовую кровяную кардиоплегию повторяют через 20 минутные интервалы для поддержания электромеханической пассивности и гипотермии миокарда. Инфузии, как правило, выполняют ретроградно и одновременно через венозные шунты со скоростью 200 мл/мин в течение 1 мин. В отдельных случаях возможно также проведение кардиоплегии антеградно в корень аорты либо селективно через канюли, устанавливаемые в устья коронарных артерий.
- Реперфузия теплой кровью (hot-shot). Перед снятием зажима с аорты выполняют нормотермическую кардиоплегию кровью, обогащенной субстратами. Этот теплый реперфузат обычно подается через коронарный синус и венозные шунты в течение 1 мин, после чего следует кратковременная (20-30 с) ретроградная реперфузия миокарда кровью нормальной температуры, которую прекращают при появлении видимой электрической и механической активности сердца. После этого зажим с аорты снимают.
![]() Применение данного метода обычно позволяет остановить ИК через 5 мин
после снятия зажима с аорты.
Применение данного метода обычно позволяет остановить ИК через 5 мин
после снятия зажима с аорты.
ПРИМЕНЕНИЕ ОСОБЫХ МЕТОДОВ КРОВЯНОЙ КАРДИОПЛЕГИИ В СПЕЦИФИЧЕСКИХ КЛИНИЧЕСКИХ СИТУАЦИЯХ
![]() Концепция тепловой индукции кардиоплегии была предложена для «активного
оживления» ишемически поврежденного сердца, обедненного энергией и субстратами,
с целью более быстрого его восстановления и снижения потребности в кислороде
на фоне поддержания электромеханической пассивности [3]. При этом кровяная
кардиоплегия дополняется аминокислотами (глутаматом и аспартатом) для
восполнения интермедиатов цикла Кребса, дефицит которых имеет место при
кардиогенном шоке с выраженным снижением фракции выброса и при остром
инфаркте миокарда.
Концепция тепловой индукции кардиоплегии была предложена для «активного
оживления» ишемически поврежденного сердца, обедненного энергией и субстратами,
с целью более быстрого его восстановления и снижения потребности в кислороде
на фоне поддержания электромеханической пассивности [3]. При этом кровяная
кардиоплегия дополняется аминокислотами (глутаматом и аспартатом) для
восполнения интермедиатов цикла Кребса, дефицит которых имеет место при
кардиогенном шоке с выраженным снижением фракции выброса и при остром
инфаркте миокарда.
![]() Нормотермическая кровяная кардиоплегия (раствор для тепловой индукции,
табл.1) подается в корень аорты под контролем давления (40-60 мм рт.
ст.) сначала со скоростью 250-300 мл/мин до остановки сердца, после чего
скорость снижают до 150 мл/мин. После выполнения процедуры в течение
1 мин, если остановка сердца достигнута, переходят к ретроградной подаче
теплого раствора (также в течение 1 мин), после чего проводят стандартную
холодовую кровяную кардиоплегию.
Нормотермическая кровяная кардиоплегия (раствор для тепловой индукции,
табл.1) подается в корень аорты под контролем давления (40-60 мм рт.
ст.) сначала со скоростью 250-300 мл/мин до остановки сердца, после чего
скорость снижают до 150 мл/мин. После выполнения процедуры в течение
1 мин, если остановка сердца достигнута, переходят к ретроградной подаче
теплого раствора (также в течение 1 мин), после чего проводят стандартную
холодовую кровяную кардиоплегию.
Таблица 1
Состав кровяной кардиоплегии по Buckberg/Beyersdorf
| Соединение | Назначение (единицы) |
Холодовая индукция |
Тепловая индукция |
"Hot shot" | Управляемая реперфузия |
| Трометамин | Буфер (рН) | 7,7-7,8 | 7,5-7,6 | 7,5-7,6 | 7,6-7,8 |
Цитрат-фосфат-декстроза |
Уменьшение содержания Са (ммоль/л) |
0,5-0,6 | 0,15-0,25 | 0,15-0,25 | 0,15-0,2 |
| Глюкоза | Осмолярность |
340-360 | 380-400 | 380-400 | 350-400 |
| KCl | Собственно плегия |
18-20 | 20-25 | 8-10 | 10-14 |
| Глутамат, аспартат | Субстраты цикла Кребса |
13 | 13 | 13 | 13 |
УПРАВЛЯЕМАЯ РЕПЕРФУЗИЯ
 |
|
КРОВЯНАЯ КАРДИОПЛЕГИЯ И ЛЕЙКОФИЛЬТРАЦИЯ
![]() Ишемия и реперфузия миокарда сопровождается активацией нейтрофилов
с последующей экспрессией адгезивных молекул на поверхности эндотелия
коронарных сосудов. В случаях длительного пережатия аорты, исходно сниженной
фракции выброса, острого инфаркта миокарда, трасплантации сердца активированные
лейкоциты, присутствующие как в кровяной кардиоплегии, так и в реперфузате,
могут вызвать значительное повреждение миокарда. В ряде клинических исследований
был продемонстрирован благоприятный эффект фильтрации кровяной кардиоплегии
в подобных ситуациях [6-8]. Экспериментальные работы показали, что для
заметного снижения реперфузионного повреждения по крайней мере 90% лейкоцитов
должны быть удалены из перфузата. Кроме того, удаление лейкоцитов следует
проводить в течение 5-10 мин после начала реперфузии, и лишь после этого
снимать зажим с аорты.
Ишемия и реперфузия миокарда сопровождается активацией нейтрофилов
с последующей экспрессией адгезивных молекул на поверхности эндотелия
коронарных сосудов. В случаях длительного пережатия аорты, исходно сниженной
фракции выброса, острого инфаркта миокарда, трасплантации сердца активированные
лейкоциты, присутствующие как в кровяной кардиоплегии, так и в реперфузате,
могут вызвать значительное повреждение миокарда. В ряде клинических исследований
был продемонстрирован благоприятный эффект фильтрации кровяной кардиоплегии
в подобных ситуациях [6-8]. Экспериментальные работы показали, что для
заметного снижения реперфузионного повреждения по крайней мере 90% лейкоцитов
должны быть удалены из перфузата. Кроме того, удаление лейкоцитов следует
проводить в течение 5-10 мин после начала реперфузии, и лишь после этого
снимать зажим с аорты.
![]() Имеющиеся на рынке лейкоцитарные фильтры для кровяной кардиоплегии
обеспечивают удаление более 90% лейкоцитов из объема перфузата до 1500
мл (например, Pall BC1B) [MMCTSLink 108]
Имеющиеся на рынке лейкоцитарные фильтры для кровяной кардиоплегии
обеспечивают удаление более 90% лейкоцитов из объема перфузата до 1500
мл (например, Pall BC1B) [MMCTSLink 108]
КРОВЯНАЯ КАРДИОПЛЕГИЯ В ТРАНСПЛАНТАЦИИ СЕРДЦА
![]() Применяется обедненная лейкоцитами кровяная кардиоплегия, которую начинают
проводить ретроградно сразу после извлечения сердца из консервирующего
раствора. Для этого в коронарный синус устанавливается катетер, который
фиксируют кисетным швом с турникетом. Сначала в течение 3 мин выполняют
кардиоплегию холодной кровью. Вторую порцию кардиоплегии (также холодной
кровью) вводят в течение 2 мин через 20 мин, что примерно соответствует
окончанию подшивания правого предсердия. Третий и последний этап – реперфузия
теплой, обедненной лейкоцитами и обогащенной субстратами кровяной кардиоплегией
в течение 45 с. Затем, вплоть до восстановления сократительной активности
пересаженного сердца, продолжают ретроградную перфузию теплой, обедненной
лейкоцитами кровью.
Применяется обедненная лейкоцитами кровяная кардиоплегия, которую начинают
проводить ретроградно сразу после извлечения сердца из консервирующего
раствора. Для этого в коронарный синус устанавливается катетер, который
фиксируют кисетным швом с турникетом. Сначала в течение 3 мин выполняют
кардиоплегию холодной кровью. Вторую порцию кардиоплегии (также холодной
кровью) вводят в течение 2 мин через 20 мин, что примерно соответствует
окончанию подшивания правого предсердия. Третий и последний этап – реперфузия
теплой, обедненной лейкоцитами и обогащенной субстратами кровяной кардиоплегией
в течение 45 с. Затем, вплоть до восстановления сократительной активности
пересаженного сердца, продолжают ретроградную перфузию теплой, обедненной
лейкоцитами кровью.
ДРУГИЕ МЕТОДИКИ ПРИМЕНЕНИЯ КРОВЯНОЙ КАРДИОПЛЕГИИ
![]() В дополнение к классической «стандартной технике», были разработаны
и применяются в различных центрах следующие модификации кровяной кардиоплегии.
В дополнение к классической «стандартной технике», были разработаны
и применяются в различных центрах следующие модификации кровяной кардиоплегии.
НЕПРЕРЫВНАЯ КАРДИОПЛЕГИЯ ТЕПЛОЙ КРОВЬЮ
![]() Целью данной методики является полное предотвращение любой ишемии миокарда
в период пережатия аорты путем непрерывной ретроградной подачи теплой
кровяной кардиоплегии [9]. На практике большинство хирургов прерывают
подачу перфузата на несколько минут для наложения дистальных анастомозов,
что ведет к "ненамеренной" ишемии миокарда. Еще одной потенциальной проблемой,
связанной с использованием данной методики, является передозировка кардиоплегии.
Целью данной методики является полное предотвращение любой ишемии миокарда
в период пережатия аорты путем непрерывной ретроградной подачи теплой
кровяной кардиоплегии [9]. На практике большинство хирургов прерывают
подачу перфузата на несколько минут для наложения дистальных анастомозов,
что ведет к "ненамеренной" ишемии миокарда. Еще одной потенциальной проблемой,
связанной с использованием данной методики, является передозировка кардиоплегии.
ПОВТОРНАЯ АНТЕГРАДНАЯ КАРДИОПЛЕГИЯ ТЕПЛОЙ КРОВЬЮ
![]() Автором данной концепции является Calafiore. Она была разработана в
связи с проблемой крови в операционном поле при использовании непрерывной
кровяной кардиоплегии [10]. Кровь нормальной температуры смешивается
с калиевым раствором, подаваемым шприцевым насосом. Повторные инфузии
проводятся каждые 15 мин. Гипотермия полностью исключается. Наличие критических
коронарных стенозов при антеградном введении ограничивает доставку плегической
смеси к ишемизированным областям миокарда, особенно к бассейну передней
нисходящей артерии в случаях ее шунтирования внутренней грудной артерией,
когда перфузия через венозный шунт исключается. Подобная неадекватная
защита миокарда с использованием только антеградного пути может привести
к ишемическому повреждению.
Автором данной концепции является Calafiore. Она была разработана в
связи с проблемой крови в операционном поле при использовании непрерывной
кровяной кардиоплегии [10]. Кровь нормальной температуры смешивается
с калиевым раствором, подаваемым шприцевым насосом. Повторные инфузии
проводятся каждые 15 мин. Гипотермия полностью исключается. Наличие критических
коронарных стенозов при антеградном введении ограничивает доставку плегической
смеси к ишемизированным областям миокарда, особенно к бассейну передней
нисходящей артерии в случаях ее шунтирования внутренней грудной артерией,
когда перфузия через венозный шунт исключается. Подобная неадекватная
защита миокарда с использованием только антеградного пути может привести
к ишемическому повреждению.
"ПРОХЛАДНАЯ" ("ТЕПЛОВАТАЯ", TEPID) КРОВЯНАЯ КАРДИОПЛЕГИЯ
![]() Антеградная "прохладная" кровяная кардиоплегия была введена в клиническую
практику группой из Торонто [11]. Идея состояла в комбинации преимуществ
теплового и холодового методов для сведения к минимуму нежелательных
эффектов кровяной кардиоплегии [11]. Понижение температуры сердца с 37oС
до 29oС не влияет на потребление миокардом кислорода и одновременно снижает
уровень лактата.
Антеградная "прохладная" кровяная кардиоплегия была введена в клиническую
практику группой из Торонто [11]. Идея состояла в комбинации преимуществ
теплового и холодового методов для сведения к минимуму нежелательных
эффектов кровяной кардиоплегии [11]. Понижение температуры сердца с 37oС
до 29oС не влияет на потребление миокардом кислорода и одновременно снижает
уровень лактата.
РЕЗУЛЬТАТЫ
![]() В современной кардиохирургии остановка сердца с помощью кровяной кардиоплегии
является наиболее предпочтительным методом. Переход от кристаллоидной
к кровяной кардиоплегии явился результатом экспериментальных и клинических
исследований, продемонстрировавших лучшую защиту миокарда при использовании
данного метода [12-14].
В современной кардиохирургии остановка сердца с помощью кровяной кардиоплегии
является наиболее предпочтительным методом. Переход от кристаллоидной
к кровяной кардиоплегии явился результатом экспериментальных и клинических
исследований, продемонстрировавших лучшую защиту миокарда при использовании
данного метода [12-14].
![]() Эффективность защиты миокарда посредством кровяной кардиоплегии была
оценена F.Loop в клиническом исследовании, включавшем 819 пациентов (распределенных
по группам риска), которые сравнивались с 2582 больными с антеградной
кристаллоидной кардиоплегией [13]. Использование комбинированной анте/ретроградной
кровяной кардиоплегии обеспечило снижение частоты послеоперационных осложнений
за счет значительного уменьшения числа периоперационных инфарктов, осложнений
со стороны операционной раны и длительности пребывания в клинике среди
пациентов с повторными вмешательствами. Однако показатели годовой выживаемости
среди пациентов этих двух групп значимо не различались.
Эффективность защиты миокарда посредством кровяной кардиоплегии была
оценена F.Loop в клиническом исследовании, включавшем 819 пациентов (распределенных
по группам риска), которые сравнивались с 2582 больными с антеградной
кристаллоидной кардиоплегией [13]. Использование комбинированной анте/ретроградной
кровяной кардиоплегии обеспечило снижение частоты послеоперационных осложнений
за счет значительного уменьшения числа периоперационных инфарктов, осложнений
со стороны операционной раны и длительности пребывания в клинике среди
пациентов с повторными вмешательствами. Однако показатели годовой выживаемости
среди пациентов этих двух групп значимо не различались.
![]() J.Kirklin сравнивал результаты аортокоронарного шунтирования в 1977-1981
гг. (эра кристаллоидной кардиоплегии) с данными 1986-1988 гг., когда
у пациентов с длительным временем пережатия аорты начали применять холодовую
кровяную кардиоплегию и реперфузию теплой кровью [14]. В группе пациентов
с временем пережатия аорты 180 и более мин применение кровяной кардиоплегии
привело к существенному снижению 30-дневной летальности (с 7,3% до 1,7%).
Эти клинические результаты подтвердили экспериментальные данные и показали,
что контролируемая реперфузия теплой кровью служит мощным инструментом
для уменьшения пагубного воздействия длительных периодов ишемии и для
снижения реперфузионного повреждения.
J.Kirklin сравнивал результаты аортокоронарного шунтирования в 1977-1981
гг. (эра кристаллоидной кардиоплегии) с данными 1986-1988 гг., когда
у пациентов с длительным временем пережатия аорты начали применять холодовую
кровяную кардиоплегию и реперфузию теплой кровью [14]. В группе пациентов
с временем пережатия аорты 180 и более мин применение кровяной кардиоплегии
привело к существенному снижению 30-дневной летальности (с 7,3% до 1,7%).
Эти клинические результаты подтвердили экспериментальные данные и показали,
что контролируемая реперфузия теплой кровью служит мощным инструментом
для уменьшения пагубного воздействия длительных периодов ишемии и для
снижения реперфузионного повреждения.
![]() Авторы многоцентрового исследования по сравнительной оценке непрерывной
тепловой и повторной холодовой кровяной кардиоплегии установили, что
оба метода обладают приблизительно одинаковой эффективностью в аспектах
летальности, частоты периоперационных инфарктов и потребности в баллонной
контрпульсации в постперфузионном периоде [15].
Авторы многоцентрового исследования по сравнительной оценке непрерывной
тепловой и повторной холодовой кровяной кардиоплегии установили, что
оба метода обладают приблизительно одинаковой эффективностью в аспектах
летальности, частоты периоперационных инфарктов и потребности в баллонной
контрпульсации в постперфузионном периоде [15].
![]() В исследовании Т.Martin с соавт. [16], которые на материале 1001 операции
сравнивали по тем же критериям непрерывную тепловую кровяную и повторную
холодовую кристаллоидную кардиоплегию, также не было выявлено существенных
различий между методами. Более того, в группе пациентов с тепловой кровяной
кардиоплегией неожиданно высокой оказалась частота периоперационных инсультов
и прочих неврологических осложнений.
В исследовании Т.Martin с соавт. [16], которые на материале 1001 операции
сравнивали по тем же критериям непрерывную тепловую кровяную и повторную
холодовую кристаллоидную кардиоплегию, также не было выявлено существенных
различий между методами. Более того, в группе пациентов с тепловой кровяной
кардиоплегией неожиданно высокой оказалась частота периоперационных инсультов
и прочих неврологических осложнений.
![]() J.Flack [17] на большой группе пациентов с ИБС высокого риска (фракция
выброса <36%) показал, что применение кровяной кардиоплегии вместо
кристаллоидной сопровождалось значительным снижением операционной летальности
(0,3% и 2%, соответственно), периоперационных инфарктов (2% и 10%) и
нарушений проводимости (12,4% и 21,6%). Однако существенной разницы в
показателях ранней и отдаленной выживаемости отмечено не было.
J.Flack [17] на большой группе пациентов с ИБС высокого риска (фракция
выброса <36%) показал, что применение кровяной кардиоплегии вместо
кристаллоидной сопровождалось значительным снижением операционной летальности
(0,3% и 2%, соответственно), периоперационных инфарктов (2% и 10%) и
нарушений проводимости (12,4% и 21,6%). Однако существенной разницы в
показателях ранней и отдаленной выживаемости отмечено не было.
ОБСУЖДЕНИЕ
![]() Многообразие вариантов кровяной кардиоплегии дает хирургу инструмент
для активного восстановления нарушенных функций миокарда и для предупреждения
ишемического повреждения. Преимущества крови как кардиоплегического носителя
включают высокую кислородно-транспортную емкость, способность восстанавливать
энергетические и метаболические ресурсы миокарда, предупреждение реперфузионного
повреждения, снижение гемодилюции, онкотические, буферные, реологические
свойства и наличие эндогенных антиоксидантов. Главным условием реализации
этих преимуществ является адекватная доставка кардиоплегического раствора.
Многообразие вариантов кровяной кардиоплегии дает хирургу инструмент
для активного восстановления нарушенных функций миокарда и для предупреждения
ишемического повреждения. Преимущества крови как кардиоплегического носителя
включают высокую кислородно-транспортную емкость, способность восстанавливать
энергетические и метаболические ресурсы миокарда, предупреждение реперфузионного
повреждения, снижение гемодилюции, онкотические, буферные, реологические
свойства и наличие эндогенных антиоксидантов. Главным условием реализации
этих преимуществ является адекватная доставка кардиоплегического раствора.
![]() Существующие стандарты защиты миокарда посредством кровяной кардиоплегии
формировались на протяжении последних десятилетий как следствие экспериментальных
исследований и их последующего клинического приложения. Они совмещают
различные подходы, такие как холодовая кровяная кардиоплегия, кардиоплегическая
реперфузия теплой кровью, тепловая индукция а также последовательная
и одновременная анте- и ретроградная подача. Комбинация данных опций
позволяет компенсировать ограничения каждой из них и обеспечить оптимальную
защиту миокарда.
Существующие стандарты защиты миокарда посредством кровяной кардиоплегии
формировались на протяжении последних десятилетий как следствие экспериментальных
исследований и их последующего клинического приложения. Они совмещают
различные подходы, такие как холодовая кровяная кардиоплегия, кардиоплегическая
реперфузия теплой кровью, тепловая индукция а также последовательная
и одновременная анте- и ретроградная подача. Комбинация данных опций
позволяет компенсировать ограничения каждой из них и обеспечить оптимальную
защиту миокарда.
![]() Для достижения желаемого защитного эффекта важно использовать методики,
наиболее оптимальные в данном случае. Некоторые хирурги, незнакомые с
кровяной кардиоплегией, критикуют ее, как громоздкую и чересчур сложную
по сравнению с простым введением кристаллоидного раствора. Однако в данном
случае простота и безопасность не есть синонимы [18]. Повреждение сердца
при неадекватной защите, приводящее к синдрому низкого выброса, может
удлинить время и стоимость госпитализации, а впоследствии привести к
фиброзу миокарда.
Для достижения желаемого защитного эффекта важно использовать методики,
наиболее оптимальные в данном случае. Некоторые хирурги, незнакомые с
кровяной кардиоплегией, критикуют ее, как громоздкую и чересчур сложную
по сравнению с простым введением кристаллоидного раствора. Однако в данном
случае простота и безопасность не есть синонимы [18]. Повреждение сердца
при неадекватной защите, приводящее к синдрому низкого выброса, может
удлинить время и стоимость госпитализации, а впоследствии привести к
фиброзу миокарда.
ЛИТЕРАТУРА
- Siegenthaler MP. Antegrade administration of cardioplegia. Multimed Man Cardiothorac Surg doi:10.1510/mmcts.2004.000695.
- Bothe W. Retrograde administration. Multimed Man Cardiothorac Surg doi:10.1510/mmcts.2004.000711.
- Rosenkranz ER, Okamoto F, Buckberg GD, Robertson JM, Vinten-Johansen J, Bugyi HI. Safety of prolonged aortic clamping with blood cardioplegia. III. Aspartate enrichment of glutamate-blood cardioplegia in energy-depleted hearts after ischemic and reperfusion injury. J Thorac Cardiovasc Surg 1986;91:428–435.
- Beyersdorf F. Coronary sinus interventions during surgical treatment of acute myocardial infarction in Mohl W, editor. Coronary sinus interventions in cardiac surgery, R.G. Landes Company, 1994.
- Allen BS, Buckberg GD, Fontan FM, Kirsh MM, Popoff G, Beyersdorf F, Fabiani JN, Acar C. Superiority of controlled surgical reperfusion versus percutaneous transluminal coronary angioplasty in acute coronary occlusion. J Thorac Cardiovasc Surg 1993;105:864–879.
- Hayashi Y, Sawa Y, Fukuyama N, Miyamoto Y, Takahashi T, Nakazawa H, Matsuda H. Leukocyte-depleted terminal blood cardioplegia provides superior myocardial protective effects in association with myocardium-derived nitric oxide and peroxynitrite production for patients undergoing prolonged aortic crossclamping for more than 120 min. J Thorac Cardiovasc Surg 2003;126:1813–1821.
- Pearl JM, Drinkwater DC, Laks H, Capouya ER, Gates RN. Leukocyte-depleted reperfusion of transplanted hearts: a randomized, double-blind clinical trial. J Heart Lung Transplant 1992;11:1082–1092.
- Martin J, Krause M, Benk C, Lutter G, Siegenthaler MP, Beyersdorf F. Blood cardioplegia filtration. Perfusion 2003;18(Suppl 1)75–80.
- Salerno TA, Houck JP, Barrozo CAM, Panos A, Christakis GT, Abel JG, Lichtenstein SV. Retrograde continuous warm blood cardioplegia: a new concept in myocardial protection. Ann Thorac Surg 1991;51:245–247.
- 10. Calafiore AM, Teodori G, Mezzetti A, Bosco G, Verna AM, Di Giammarco G, Lapenna D. Intermittent antegrade warm blood cardioplegia. Ann Thorac Surg 1995;59:398–402.
- Hayashida N, Ikonomidis JS, Weisel RD, Shirai T, Ivanov J, Carson SM, Mohabeer MK, Tumiati LC, Mickle DA. The optimal cardioplegic temperature. Ann Thorac Surg 1994;58:961–971.
- Schlensak C, Doenst T, Beyersdorf F. Clinical experience with blood cardioplegia. Thorac Cardiovasc Surg 1998;46(Suppl 2):282–285.
- Loop FD, Higgins TL, Panda R, Pearce G, Estafanous FG. Myocardial protection during cardiac operations. Decreased morbidity and lower cost with blood cardioplegia and coronary sinus perfusion. J Thorac Cardiovasc Surg 1992;104:608–618.
- Kirklin JW. The science of cardiac surgery. Eur J Cardiothorac Surg 1990;4:63–71.
- Naylor CK, Lichtenstein SV, Fremes SE, Warm Heart Investigators. Randomized trial of normothermic versus hypothermic coronary bypass surgery. Lancet 1994;343:559–563.
- Martin TD, Craver JM, Gott JP, Weintraub WS, Ramsay J, Guyton RA. Prospective, randomized trial of retrograde warm blood cardioplegia: myocardial benefit and neurologic threat. Ann Thorac Surg 1994;57:298–304.
- Flack JE, Cook JR, May SJ, Lemeshow S, Engelman RM, Rousou JA, Deaton DW. Does cardioplegia type affect outcome and survival in patients with advanced left ventricular dysfunction? Results from the CABG trial. Circulation 2000;102(Suppl 3):III84–89.
- Buckberg GD. Update on current techniques of myocardial protection. Ann Thorac Surg 1995;60:805–814.